martes, 9 de agosto de 2016
martes, 2 de agosto de 2016
balanceo de ecuaciones químicas
BALANCEO DE ECUACIONES
QUÍMICAS POR MÉTODO
DE TANTEO Y OXIDO REDUCCIÓN
INTRODUCCIÓN:
para manifestar un cambio en la materia, se utiliza una ecuación química que es la forma de representar como se altera la naturaleza de los elementos o como reacciona uno al contacto con otros. si deseamos comprender estas alteraciones, debemos ser capaces de equilibrar o balancear ecuaciones químicas
OBJETIVO
El objetivo de este, es presentar como se balancea una ecuación química por el método de tanteo y oxido reducción, con el propósito de un entendimiento previo y de fácil comprensión
MARCO TEÓRICO
Reacción química y ecuaciones químicas
Una Reacción química es un proceso en el cual una sustancia (o sustancias) desaparece para formar una o más sustancias nuevas.
Las ecuaciones químicas son el modo de representar a las reacciones químicas.
Por ejemplo el hidrógeno gas (H2) puede reaccionar con oxígeno gas(O2) para dar agua (H20). La ecuación química para esta reacción se escribe:

El "+" se lee como "reacciona con"
La flecha significa "produce".
Las fórmulas químicas a la izquierda de la flecha representan las sustancias de partida denominadas reactivos.
A la derecha de la flecha están las formulas químicas de las sustancias producidas denominadas productos.
Los números al lado de las formulas son los coeficientes (el coeficiente 1 se omite).
Ecuación química
Es la representación gráfica o simbólica de una reacción química que muestra las sustancias, elementos o compuestos que reaccionan (llamados reactantes o reactivos) y los productos que se obtienen. La ecuación química también nos muestra la cantidad de sustancias o elementos que intervienen en la reacción, en sí es la manera de representarlas.
Reacción química
Es también llamado cambio químico y se define como todo proceso químico en el cual una o más sustancias sufren transformaciones químicas. Las sustancias llamas reactantes se combina para formar productos.
En la reacción química intervienen elementos y compuestos. Un ejemplo de ello es el Cloruro de Sodio (NaCl) o comúnmente conocido como "sal de mesa" o "sal común".
La diferencia entre una ecuación y una reacción química es simple: En la ecuación es la representación simbólica lo cual utilizamos letras, símbolos y números para representarla, mientras que en la reacción química es la forma "practica" de la misma (Cuando se lleva a cabo).
Balanceo de una ecuación química
Balancear una ecuación significa que debe de existir una equivalencia entre el número de los reactivos y el número de los productos en una ecuación. Lo cual, existen distintos métodos, como los que veremos a continuación
Para que un balanceo sea correcto: "La suma de la masa de las sustancias reaccionantes debe ser igual a la suma de las
Masas de los productos"
Veremos 3 tipos de balanceo de ecuaciones químicas: Balanceo por TANTEO, OXIDO-REDUCCIÓN (REDOX) Y MATEMATICO O ALGEBRAICO:
BALANCEO POR TANTEO
Para balancear por este o todos los demás métodos es necesario conocer la Ley de la conservación de la materia, propuesta por Lavoisier en 1774. Dice lo siguiente
"En una reacción química, la masa de los reactantes es igual a la masa de los reactivos" por lo tanto "La materia no se crea ni se destruye, solo se transforma"
Como todo lleva un orden a seguir, éste método resulta más fácil si ordenamos a los elementos de la siguiente manera:
Balancear primero
Metales y/o no metales
Oxígenos
Hidrógenos
De esta manera, nos resulta más fácil, ya que el mayor conflicto que se genera durante el balanceo es causado principalmente por los oxígenos e hidrógenos.
Balancear por el método de tanteo consiste en colocar números grandes denominados "Coeficientes" a la derecha del compuesto o elemento del que se trate. De manera que Tanteando, logremos una equivalencia o igualdad entre los reactivos y los productos.
Ejemplo:
Balancear la siguiente ecuación química:

Continuamos: ¿Cuántos oxígenos hay en el primer miembro? Encontramos 4 porque 3 mas 1 es igual a 4
Y ¿Cuántos en el segundo? Encontramos 6 porque el dos (situado a la izquierda del Fe) se multiplica por el subíndice encontrado a la derecha del paréntesis final y se multiplica 2*3 = 6
Por lo tanto en el segundo miembro hay 6 oxígenos.
Entonces colocamos un 3 del lado izquierdo del hidrógeno en el primer miembro para tener 6 oxígenos
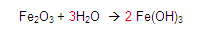
Posteriormente, Vamos con los hidrógenos, en el primer miembro vemos que hay 6 hidrógenos y en el segundo igualmente 6.
Entonces concluimos de la siguiente manera:
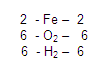
Por lo tanto, la ecuación está balanceada.
El balanceo de las ecuaciones químicas, consiste en establecer la cantidad de sustancias que intervienen en una reacción química para que correspondan con la cantidad de sustancias producidas, es decir, que los elementos que reaccionan en el primer miembro de la ecuación son los mismos que quedan después de la reacción en el segundo miembro de la ecuación.
Uno de los métodos para balancear una ecuación es el método por tanteo. En este método intentaremos equilibrar el número de átomos en la ecuación química, modificando los valores de las sustancias presente de uno o ambos lados, para que exista igualdad entre el número de átomos de las sustancias reaccionantes y las sustancias producidas. Es un método de ensayo y error.
Cuando estudiamos una reacción química compleja, existe la duda sobre si la cantidad de sustancias que reaccionan y las sustancias producidas son iguales en ambos lados de la ecuación. Aplicando el balanceo por tanteo, seguiremos los siguientes pasos:
Ejemplo de balanceo por tanteo de neutralización del sulfato de sodio con el ácido clorhídrico:
1. Tomamos en consideración los radicales de las sustancias que reaccionan, así como las que se producen. Veamos las siguiente reacción de neutralización del sulfato de sodio con el ácido clorhídrico:
Na2SO3 + HCl -- > NaCl + H2O + SO2
Como podemos ver, tenemos del lado izquierdo de la ecuación las sustancias reaccionantes: sulfato de sodio (Na2SO3) y ácido clorhídrico (HCl). Del lado derecho, tenemos los productos de la reacción: Cloruro de sodio o sal común (NaCl), Agua (H2O) y óxido de azúfre (SO2).
Podemos ver en esta ecuación las sustancias que reaccionan y las que se producen, con sus respectivas fórmulas. Sin embargo, para saber si esta ecuación está balanceada, debemos contar el número de átomos de uno y otro lado; si el total es el mismo de ambos lados entonces consideramos que la ecuación está balanceada. Así tenemos:
2 + 1 + 3 + 1+ 1 -- > 1 + 1 + 2 + 1 + 1 + 2
Na2SO3 + HCl -- > NaCl + H2O + SO2
Como podemos ver, el número de átomos en el primer miembro de la ecuación es menor que el segundo, por lo que la ecuación está desbalanceada.
2. Comenzaremos por identificar el número de átomos de cada elemento en ambos lados de la ecuación:
Lado izquierdo: Na = 2; S = 1; O = 3; H = 1; Cl = 1
Lado derecho : Na = 1; S = 1; O = 3; H = 2; Cl = 1
Así tenemos que del lado derecho de nuestra ecuación nos falta un átomo de sodio, mientras que sobra un átomo de hidrógeno.
3. Para balancear una ecuación al tanteo, tenemos que seguir las siguientes reglas:
a. No agregaremos elementos que no pertenezcan a la ecuación.
b. No modificaremos los radicales de los elementos de la ecuación, es decir, si de un lado el hidrógeno tiene un radical 2, debe seguir con el radical 2.
c. Sí podemos expresar al aumento de átomos agregando el número de átomos de alguno de los compuestos de la mezcla. Así, si queremos expresar que hay 4 átomos de ácido clorhídrico, escribiremos 4HCl.
d. Es conveniente comenzar el balanceo por los elementos que sólo aparecen una vez en cada miembro, dejando al último los que aparecen más de una vez, si es necesario.
e. El hidrógeno y el oxígeno son de los últimos elementos a considerar para el balanceo.
4. No tenemos un lugar definido para comenzar nuestro balanceo, así que podemos comenzar por cualquiera de los miembros de la ecuación. Comenzaremos con los átomos de sodio. Como vemos, en el primer miembro hay dos átomos de sodio para reaccionar en la molécula de sulfato de sodio, mientras que del lado derecho, en la sustancia producida, el cloruro de sodio, sólo hay un átomo de sodio. Esto significa que para equilibrar el sodio y que haya dos átomos en el resultado, debe haber dos moléculas de cloruro de sodio en el lado derecho de la reacción. Así tendríamos:
2 + 1 + 3 + 1+ 1 -- > 2 +2 + 2 + 1 + 1 + 2
Na2SO3 + HCl -- > 2NaCl + H2O + SO2
5. Como vemos, ya tenemos la misma cantidad de átomos de sodio. Pero nuestra ecuación sigue desequilibrada. En efecto, ahora tenemos:
Lado izquierdo: Na = 2; S = 1; O = 3; H = 1; Cl = 1
Lado derecho : Na = 2; S = 1; O = 3; H = 2; Cl = 2
6. Ahora tenemos dos átomos de cloro en el resultado y sólo uno en los reactivos. Si consideramos que el resultado de la reacción produce dos átomos de sal, y sólo hay un átomo de cloro en la molécula que reacciona, significa que ahora debemos considerar que actúan dos moléculas del compuesto que contiene el cloro, o sea, dos moléculas de ácido clorhídrico. Para comprobar si nuestra suposición es cierta, agregamos a nuestra fórmula la indicación de que están reaccionando dos átomos de HCl y volvemos a contar los átomos:
2 + 1 + 3 + 2 + 2 -- > 2 +2 + 2 + 1 + 1 + 2
Na2SO3 + 2HCl -- > 2NaCl + H2O + SO2
7. Ahora ya tenemos el mismo número de átomos reaccionando de uno y otro lado de la ecucación. Finalmente revisamos que en ambos lados exista el mismo número de átomos de cada elemento:
Lado izquierdo: Na = 2; S = 1; O = 3; H = 2; Cl = 2
Lado derecho : Na = 2; S = 1; O = 3; H = 2; Cl = 2
Tenemos el mismo número de átomos de cada elemento en ambos lados de la ecuación, lo que significa que nuestra fórmula está correctamente balanceada. También podemos apreciar que al comenzar a balancear por los elementos que sólo aparecen una vez, otros átomos, en este caso el hidrógeno, cambia sus valores dependiendo de la molécula en la que se encuentra combinado y la cantidad de moléculas que actúan en la ecuación, equilibrándose también junto con el resto de elementos.
Ejemplo de balanceo por tanteo del ácido nítrico con el hidróxido de calcio:
Ahora vamos a balancear la ecuación de la reacción del ácido nitrico con el hidróxido de calcio, la cual produce nitrato de calcio y agua:
HNO3 + Ca(OH)2 -- > Ca(NO3)2 + H2O
1. Comenzamos contando los átomos en cada lado de le ecuación y los átomos de cada elemento de la ecuación:
1 + 1 + 3 + 1 + 2 + 2 -- > 1 + 2 + 6 + 2 + 1
HNO3 + Ca(OH)2 -- > Ca(NO3)2 + H2O
Lado izquierdo: N = 1; Ca = 1; O = 5; H = 3
Lado derecho : N = 2; Ca = 1; O = 7; H = 2
Comenzaremos pues nuestro balance con el nitrógeno. Del lado de las reacciones tenemos dos átomos, mientras que en los reactivos, sólo hay uno. Esto podemos equilibrarlo considerando que actúan dos moléculas de ácido nítrico, por lo que nuestra fórmula y nuestro conteo de átomos quedarían así:
2 + 2 + 6 + 1 + 2 + 2 -- > 1 + 2 + 6 + 2 + 1
2HNO3 + Ca(OH)2 -- > Ca(NO3)2 + H2O
Lado izquierdo: N = 2; Ca = 1; O = 8; H = 4
Lado derecho : N = 2; Ca = 1; O = 7; H = 2
Ya equilibramos el nitrógeno, pero la ecuación aún está desbalanceada.
2. Observando nuestra ecuación, vemos que ya tenemos el mismo número de átomos de nitrógeno y de calcio. Esto significa que ya tenemos la cantidad adecuada de moléculas de ácido nítrico y de hidróxido de calcio para producir una molécula de nitrato de calcio. Comparando los átomos de todos los elementos, tenemos que a la ecuación de lado derecho le falta una molécula de oxígeno y dos de hidrógeno para estar equilibrada ¿Esto qué significa? Bien, pues una molécula de oxígeno y dos de hidrógeno producen agua, y como ya hay una molécula de agua presente en la reacción, significa que no es una sino dos las moléculas de agua que se producen.
Agregamos a nuestra fórmula que se producen dos moléculas de agua, y volvemos a contar átomos y elementos:
2 + 2 + 6 + 1 + 2 + 2 -- > 1 + 2 + 6 + 4 + 2
2HNO3 + Ca(OH)2 -- > Ca(NO3)2 + 2H2O
Lado izquierdo: N = 2; Ca = 1; O = 8; H = 4
Lado derecho : N = 2; Ca = 1; O = 8; H = 4
Nuestra ecuación está correctamente balanceada.
BALANCEO POR EL MÉTODO DE ÓXIDO-REDUCCIÓN
Es también denominado "Redox" y consiste en que un elemento se oxida y (hablar de oxidación se refiere a que un elemento pierda electrones y su valencia aumente) el otro se reduce (cuando el elemento gana electrones y su valencia disminuye) para éste método se siguen los siguientes pasos o reglas:
1. Todos los elementos libres que no formen compuesto, tendrán valencia cero
2. El hidrógeno tendrá valencia de +1 excepto en hidruros con -1
3. El oxígeno tendrá valencia de 2- excepto en los peróxidos con -1
4. Los alcalinos tienen en sus compuestos oxidación +1
5. Los alcalinotérreos tienen en sus compuestos oxidación +2
6. Los alógenos tienen en sus compuestos con aluros oxidación -1
7. La suma de los números de oxidación de todos los átomos de un compuesto es igual a la carga de los compuestos
8. Si algún átomo se oxida su numero de oxidación aumenta y cuando un átomo se reduce, su numero de oxidación disminuye
Ejemplo:
Balancear la siguiente ecuación:
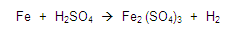
Si vemos la primera regla, esta nos dice que todos los elementos libres tendrán valencia cero, entonces vemos la ecuación y localizamos a los elementos libres, en este caso son el fierro y el hidrógeno, colocamos un cero como valencia.
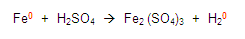
Continuamos con las demás reglas y encontramos a los oxígenos e hidrógenos y les asignamos la valencia que les corresponde, establecidas en las reglas:
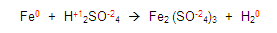
Para continuar, obtenemos la valencia de los elementos que nos sobran, en este caso el azufre y el fierro:
Ubiquémonos en el azufre (S) del primer miembro en la ecuación
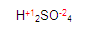
y posteriormente obtendremos la valencia del azufre. Quede claro que la del hidrógeno y la del oxígeno ya la tenemos.
Para obtener la valencia del azufre, simplemente (pon mucha atención aquí) vamos a multiplicar la valencia del oxígeno por el número de oxígenos que hay. (En este caso hay 4 oxígenos) y hacemos lo mismo con el hidrógeno, multiplicamos su valencia por el número de oxígenos que hay. Queda de la siguiente manera
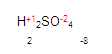
Ya que tenemos los resultados, ahora verificamos que todo elemento químico es eléctricamente neutro y lo comprobamos de la siguiente manera:
Tenemos que llegar a cero. Buscamos cuanto falta de dos para ocho. Entonces encontramos que faltan 6, este número será colocado con signo positivo +
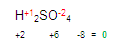
El 6 que acabamos de obtener es la valencia del azufre en el primer miembro.
Ubiquémonos en el fierro del segundo miembro en donde se encuentra el compuesto
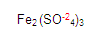
Localizamos al fierro. Para obtener su valencia primero denominamos si es monovalente o divalente etc. Ya que vimos que es divalente, necesitamos saber la valencia del radical sulfato, en este caso es
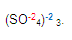
Para obtener la valencia del fierro, multiplicamos la valencia del radical (-2) con el subíndice que se encuentre fuera del mismo
Después lo dividimos entre el número de fierros que hay en el compuesto (en este caso hay dos fierros)
Queda de la siguiente manera:
2 * 3 = 6 6/2 = 3
El tres que acabamos de obtener es la valencia del fierro.
Que nos quede claro, ya tenemos la valencia del fierro que es 3, ya tenemos la valencia del oxígeno que es -2, ahora nos falta la valencia del azufre (S) lo cual realizaremos algo similar con lo dicho con anterioridad:
Multiplicamos la valencia del radical sulfato (-2) con el subíndice (3) y después con el número de oxígenos que hay dentro del paréntesis (4).

Obtenemos un total de 24. Este número que resultó se le llama valencia parcial
Después continuamos con el fierro. Ahora ya que tenemos que la valencia del fierro es 3 entonces multiplicamos la valencia por el numero de fierros que hay (hay 2)
Y nos da un resultado de 6.
Entonces:
Tenemos 6 y tenemos -24, de 6 a 24 ¿Cuánto falta?
Respuesta: +18
Ahora el 18 lo dividimos entre el número de azufres que hay: nos da un total de 6 o sea +6.
Y de esta manera ya obtuvimos todas las valencias del compuesto químico:
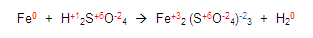
Ahora, vamos a verificar cuál elemento se oxida y cual se reduce, para esto, chequemos las valencias de los elementos, debemos verificar que en los dos miembros estén iguales.
Si vemos al fierro en el primer miembro y luego lo vemos en el segundo. Encontramos que sus valencias ya no son las mismas por tanto el elemento se está oxidando porque aumenta su valencia de cero a 3
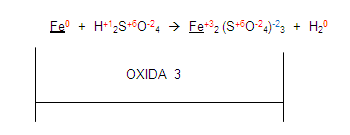
Ahora, si nos fijamos en el hidrógeno del primer miembro, se está reduciendo con el hidrógeno del segundo miembro:
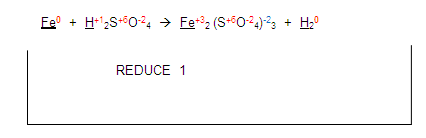
Entonces la ecuación queda de la siguiente manera:
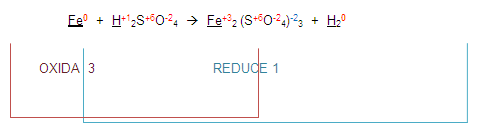
Ahora, para poder completar el balanceo, (atención) vamos a intercambiar los números que se oxidaron o redujeron. Esto es el 3 y el 1.
El 3 lo colocaremos en el lugar del 1 y el 1 en el lugar del 3
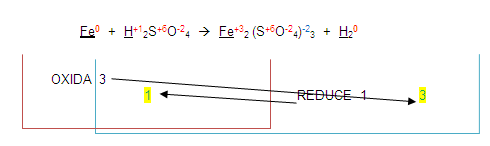
Estos números resultantes se colocan de lado izquierdo de los elementos que se oxidaron o redujeron.
El número 1 (que por lo general no se escribe) se coloca de lado izquierdo del fierro en los dos miembros.
El número 3 se coloca de lado izquierdo del hidrógeno en los dos miembros quedando de la siguiente forma:
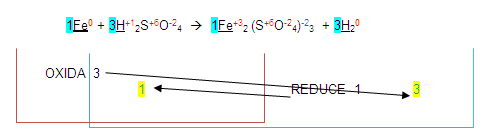
Entonces de esta manera podemos deducir que la ecuación está balanceada, pero, no es así, uno de los pasos para terminarla es: "Una vez obtenidos los números de la ecuación, se completará con método de tanteo".
Verificamos si así está balanceada:
1= Fe =2
3= S =3
12= O =12
6= H =6
Con este insignificante 2 que acabos de encontrar en el fierro del segundo miembro LA ECUACIÓN NO ESTÁ BALANCEADA aunque los demás átomos lo estén.
Completamos por tanteo
En el primer miembro (Fe) hay 1 átomo, en el segundo 2, entonces colocamos un 2 en el primer miembro y…
YA ESTÁ BALANCEADA.
Con esto finalizamos el método de REDOX.
Una reacción de óxido-reducción no es otra cosa que una pérdida y ganancia de electrones, es decir, desprendimiento o absorción de energía (presencia de luz, calor electricidad, etc.) En una reacción si un elemento se oxida, también debe de existir un elemento que se reduce.
OXIDACIÓN: es cuando un elemento pierde electrones originando que aumente su estado de oxidación.
REDUCCIÓN: es cuando un elemento gana electrones, originando que disminuya su número de oxidación.
Por ejemplo: Un cambio de numero de oxidación de +1 a +4 o de -2 a 0 es oxidación. Una cambio de +4 a +1 o de -1 a -3 es reducción.

En una reacción de redox el agente oxidante acepta electrones ( es el que se reduce) y el agente reductorsuministra electrones (es el que se oxida).
Para poder balancear por método de redox es importante recordar como determinar la cantidad de átomos de un elemento en un compuesto, así como determinar la cantidad de número de oxidación de cada elemento y conocer los pasos del método de redox.
PROCEDIMIENTO PARA EL MÉTODO DE REDOX
1.- Verificar que la ecuación este bien escrita y completa.
2.- Colocar los números de oxidación en cada uno de los elementos.
3.- Observar que números de oxidación cambiaron (un elemento se oxida y uno se reduce).
4.- Escribir la diferencia de números de oxidación de un mismo elemento.
5.- Multiplicar la diferencia de números de oxidación por los subíndices correspondientes de cada elemento.
6.- Cruzar los resultados
7..- Colocar los resultados como coeficientes en el lugar correspondiente.
8.-Completar el balanceo por tanteo.
9.- Verifica la cantidad de átomos en cada miembro de la ecuación.
10.-En caso de que todos los coeficientes sean divisibles se reducen a su mínima expresión.
EJERCICIOS
Suscribirse a:
Comentarios (Atom)


















