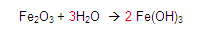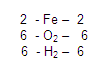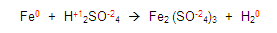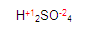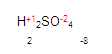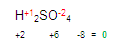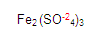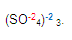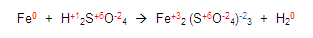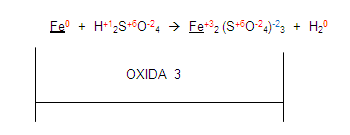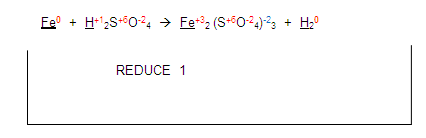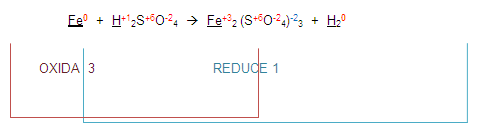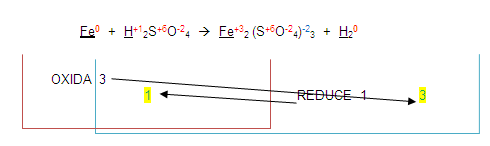GASES
INTRODUCCIÓN
Todo en el
Universo está formado por materia. La materia se puede encontrar en 3
estados de agregación o estados físicos:
sólido, líquido y gaseoso.
Para entender los
diferentes estados en los que la materia existe, es necesario entender algo
llamado Teoría Molecular cinética de la Materia. La
Teoría Molecular cinética tiene muchas partes, pero aquí
introduciremos sólo algunas. Uno de los conceptos básicos de la teoría
argumenta que los átomos y moléculas poseen una energía de movimiento, que percibimos como temperatura. En otras palabras, los átomos y moléculas
están en movimiento constante y medimos la energía de estos movimientos como la
temperatura de una sustancia. Mientras más energía hay en una sustancia, mayor
movimiento molecular y mayor la temperatura percibida. Consecuentemente, un
punto importante es que la cantidad de energía que tienen los átomos y las
moléculas (y por consiguiente la cantidad de movimiento) influye en su interacción. ¿Cómo se producen estos diferentes
estados de la materia? Los átomos que tienen poca energía interactúan
mucho y tienden a "encerrarse" y no interactuar con otros átomos. Por
consiguiente, colectivamente, estos átomos forman una sustancia dura, lo que
llamamos un sólido. Los átomos que poseen mucha energía se mueven libremente,
volando en un espacio y forman lo que llamamos gas.
Los gases se forman cuando
la energía de un sistema excede todas
las fuerzas de atracción entre moléculas. Así, las moléculas de
gas interactúan poco, ocasionalmente chocándose. En el
estado gaseoso, las moléculas se mueven rápidamente y son libres de circular
en cualquier dirección, extendiéndose en largas distancias. A
medida que la temperatura aumenta, la cantidad de movimiento de las moléculas
individuales aumenta. Los gases se expanden para llenar sus contenedores y
tienen una densidad baja. Debido a que las moléculas
individuales están ampliamente separadas y pueden circular libremente en
el estado gaseoso, los gases pueden ser
fácilmente comprimidos y pueden tener una forma indefinida.
El comportamiento de todos los gases se ajusta a
tres leyes, las cuales relacionan el volumen de un gas con su temperatura y presión. Los gases que obedecen estas leyes son
llamados gases ideales o perfectos.
MARCO TEÓRICO
CONCEPTOS
ESTADO DE AGREGACIÓN
TEMPERATURA
PRESIÓN
VOLUMEN
CANTIDAD DE GAS
ACTIVIDAD
1.- Rellena los siguientes
datos con la ayuda del simulador.
H2
|
CH4
|
Cl2
|
I2
|
|
moles
|
15 mol
|
8.3mol
|
7.5mol
|
3mol
|
masa
matraz vacío
|
175.0g
|
175.0g
|
175.0g
|
175.0g
|
masa
matraz + gas
|
205.0g
|
307.8g
|
707.5g
|
936.4g
|
masa
sólo gas
|
30g
|
132.8g
|
532.5g
|
761.4g
|
masa
molar
|
2g/mol
|
16g/mol
|
71g/mol
|
253.8g/mol
|
2.- ¿Cuántas moléculas
hay en cada matraz?
número de moléculas
|
|
matraz
vacío
|
0
|
matraz
con 15 mol de H2
|
30
|
matraz
con 8.3 mol de CH4
|
41.5
|
matraz
con 7.5 mol de Cl2
|
22.5
|
matraz
con 3 mol de I2
|
6
|
3.- ¿Cuántos
átomos hay en cada matraz?
número de átomos
|
|
matraz
vacío
|
0
|
matraz
con 15 mol de H2
|
1.8066 x 10^25
|
matraz
con 8.3 mol de CH4
|
2.49913 x 10^25
|
matraz
con 7.5 mol de Cl2
|
1.35495 x 10^25
|
matraz
con 3 mol de I2
|
3.6132 x 10^24
|
4.- ¿Cuál es
el matraz que contiene más hidrógeno?
átomos de H
|
|
matraz
con 15 mol de H2
|
|
matraz
con 8.3 mol de CH4
|
X
|
5.- Redacta un pequeño
informe explicando la estrategia que has seguido para realizar las pesadas.
Lo
primero que hice fue pesar la masa matraz vacía con ayuda del simulador, que
nos dio 175 G, de ahí pesamos cada matraz por separado; para continuar en el
siguiente de” MASA SOLO GAS” pusimos cada matraz por separado y le restamos 175
que es lo que corresponde el matraz para dejar solo el gas de cada elemento.
Para
sacar la masa molar, fue con ayuda que obtuvimos en la página.
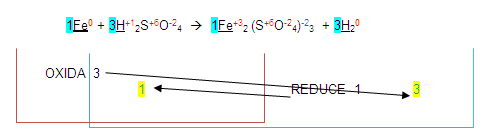
LEYES
LEYES
LEY DE CHARLES